Madrid, 14 noviembre de 2022.- Los organoides son versiones milimétricas de los órganos humanos que se fabrican, mediante métodos de cultivo celular, en los laboratorios. Estas estructuras en 3D sirven para estudiar enfermedades o para evaluar fármacos, una revolución científica que avanza desde 2008 a pasos agigantados.
Pulmón, hígado, páncreas, intestino, próstata o cerebro son solo algunos de los órganos que ya tienen su diminuta réplica y, si bien todavía existen importantes limitaciones, los modelos son cada vez más complejos y los avances más significativos: «estamos viendo cosas que parecen ciencia ficción», relata a EFE el científico Alberto Zambrano.
Experto en minipulmones artificiales, este investigador del Instituto de Salud Carlos III (ISCIII) de Madrid explica cómo se fabrican «in vitro» estas versiones miniaturizadas, para qué sirven y las principales barreras.
EL PRIMER ORGANOIDE, DE CORTEZA CEREBRAL
Los organoides son agregadores tridimensionales de células que reproducen la estructura y función del órgano nativo, y se producen principalmente a partir de células troncales (o células madre) embrionarias y de células troncales pluripotentes inducidas, que pueden autoorganizarse y crecer en esos cultivos 3D.
Las primeras se encuentran en el embrión y se obtienen justo después de la fecundación del óvulo -en el caso del equipo de Zambrano, el tejido celular que usan proviene de donaciones almacenadas en el biobanco de Granada-. Las segundas se adquieren a partir de células de un tejido concreto, como la piel, y luego se «reprograman» para lograr otros tipos.
La característica principal de ambas es que son pluripotentes, es decir, que pueden convertirse en cualquier tipo de célula. Gracias a la avanzada tecnología y bioingeniería, los científicos pueden cultivar artificialmente una masa de estas células para crear organoides, de formas heterogéneas, entre ellas esferoides.
Si bien los antecedentes hay que buscarlos en la década de los 80 y 90 cuando se logró avanzar en el campo de las células pluripotentes, los detalles del primer organoide se conocieron en 2008.
Fue del córtex cerebral. Yoshiki Sasai y su equipo del Instituto de investigación RIKEN (Japón) publicaron en la revista Cell Stem Cell la formación autoorganizada de tejidos corticales a partir de células madre embrionarias.
Demostraron que las neuronas corticales generadas fueron funcionales, trasplantables y capaces de formar conexiones adecuadas de largo alcance «in vivo» e «in vitro».
Esto fue el comienzo, indica Zambrano, pero luego vinieron muchos más, de cerebro y de otros órganos y tejidos, como el epitelio intestinal que logró el equipo del genetista Hans Clevers del Instituto Hubrecht (Nature, 2009).
«Estamos en una revolución que ha avanzado desde 2008 a pasos agigantados. Estamos viendo cosas que parecen -y que no lo son- ciencia ficción; los organoides son el futuro», señala Zambrano, de la Unidad Funcional de Investigación de Enfermedades Crónicas del ISCIII.
Los modelos son cada vez mejores, asegura, y enumera las principales aplicaciones: modelización de enfermedades, evaluación de fármacos y compuestos novedosos -incluida la terapia génica en fase experimental en la que se transfieren genes a las células del paciente- y la medicina regenerativa, que usa células para estimular e incrementar la capacidad del organismo para repararse.
MINIPULMONES DE 5 MILÍMETROS
Los ejemplos de los últimos años son múltiples. En 2018 un equipo de la Universidad de Cambridge publicó en Nature la descripción de miniplacentas que permiten conocer mejor cómo se desarrolla la placenta en la gestación y estudiar la preeclampsia, la restricción del crecimiento o la muerte fetal.
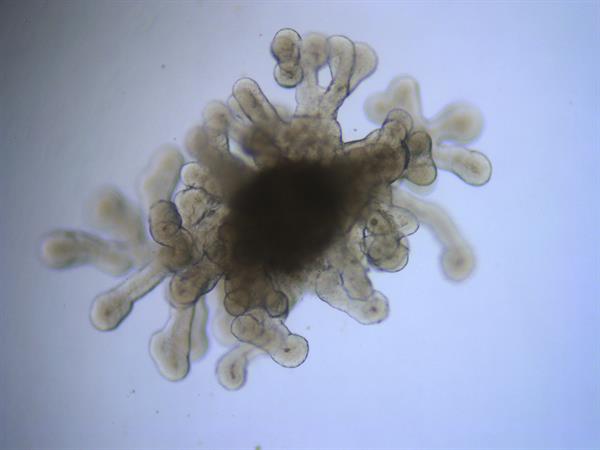
Ese mismo año Zambrano y su equipo publicaron en Stem Cell Research & Therapy los primeros resultados de sus minipulmones, con más datos en 2022. Estos modelos en 3D, con dimensiones entre los 3 y 5 milímetros -como la mayoría de organoides- imitan la actividad de los pulmones reales.
El objetivo, entre otros, profundizar en el estudio de cualquier enfermedad respiratoria (crónica, rara o infecciosa): las fibrogénicas o las que producen agentes infecciosos como el SARS-CoV-2 (responsable de la covid-19), o la bacteria neumococo. Esta es responsable de enfermedades como la neumonía o meningitis.
Estos organoides -con una forma que podría recordar a una flor- contienen casi a la perfección todo el pulmón: conductos aéreos, traquea, bronquios, estructura alveolar. «Esto es lo más avanzado que hay», afirma.
Zambrano tarda unos cuatro meses en conseguir un organoide pulmonar: las células, en este caso troncales embrionarias, se depositan en una matriz -un hidrogel- preparada para lograr su crecimiento, diferenciación y maduración hasta lograr el minipulmón.
También en el ISCIII -el equipo de Beatriz Martínez-Delgado-, junto a Cambridge y la Facultad de Medicina de Hannover, crearon minihígados para avanzar en el estudio de una enfermedad rara asociada con una grave patología hepática, mientras que en el Instituto Hubrecht consiguieron corregir en organoides, mediante edición genética, las mutaciones que causan la fibrosis quística.
Este año, desde el Hospital Universitario de Düsseldorf, científicos constataron en minicerebros que estos eran capaces de desarrollar espontáneamente copas ópticas -que dan lugar a la retina- sensibles a la luz, y el mes pasado se conoció que el equipo de Sergiu Pasca, de la Universidad de Stanford en California, implantó organoides de cerebros humanos en ratas, salvando importantes limitaciones previas.
El tejido cerebral derivado de células madre humanas (pluripotentes inducidas) fue capaz de integrarse en la corteza somatosensorial del cerebro (área responsable de recibir y procesar información sensorial) de ratas recién nacidas, influyendo en la conducta, según lo descrito en Nature.
Todos ellos son avances importantísimos, pero este campo tiene aún limitaciones.
La eficacia no es completa y en la diferenciación celular -proceso por el que una célula adquiere una forma y función determinada- pueden producirse episodios no deseables, subraya Zambrano, para quien la funcionalidad al cien por cien no será posible: nunca será igual el desarrollo embrionario humano al conseguirlo «in vitro» y el órgano nativo original al artificial, pero «nos estamos acercando bastante».
Noemí G. Gómez
EFE